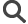Parkinson & Huntington : la greffe de neurones sains comme piste de thérapie pour les maladies neurodégénératives
Mise à jour de la page le : 25/01/2022
Porteur du projet : Erwan BEZARD – Institut des maladies neurodégénératives (IMN), Bordeaux
Titre du projet : « Parkington : Greffe d’organoïdes neuraux contrôlés pour la compensation de la neurodégénérescence dans les maladies de Parkinson et de Huntington par greffes d’organoïdes neuraux. »
Subvention attribuée par la FRC en 2018 : 46 000 €
Description du projet
Du fait du vieillissement de la population, les maladies neurodégénératives sont une préoccupation majeure de santé en France. Ces maladies, telles que la maladie de Parkinson et la maladie d’Huntington, entraînent une perte progressive de neurones spécifiques dans certaines régions du cerveau. De nombreux travaux de recherche sont menés dans le but de ralentir voire stopper la mort des neurones au cours de ces maladies. Des traitements pharmaceutiques sont disponibles, ils permettent de traiter les symptômes mais n’arrêtent pas la maladie. Une piste thérapeutique, appelée thérapie cellulaire, consiste à remplacer les neurones endommagés et pourrait offrir une nouvelle opportunité de traitement.
Le projet Parkington (contraction de « Parkinson » et « Huntington ») porté par Erwan Bezard vise à proposer une approche innovante de thérapie cellulaire pour le traitement des patients touchés par les maladies neurodégénératives (en particulier pour la maladie de Parkinson et la maladie de Huntington), afin de proposer une alternative aux traitements médicamenteux.
- L’utilisation des cellules souches : une piste de thérapie
Les cellules souches pluripotentes* offrent une véritable espérance concernant le développement de thérapie cellulaire et font l’objet d’études approfondies pour permettre une application clinique chez l’homme. Leur utilisation est une avancée majeure pour l’étude des pathologies mais aussi pour le développement de potentielles thérapies. En effet, ces cellules pourraient être greffées aux patients afin de remplacer les neurones abimés par la maladie.
Cependant, la greffe de neurones matures conduit à un taux de survie médiocre de ces cellules en raison de leur fragilité. Dans le cadre du projet Parkington, les chercheurs élaborent une nouvelle stratégie de thérapie cellulaire neuronale à partir de cellules souches pluripotentes humaines. Sur la base de résultats préliminaires solides, l’équipe d’Erwan Bezard propose l’utilisation d’organoïdes neuronaux, qui correspondent à un ensemble de neurones en 3D mimant un « mini-cerveau » et obtenus à partir de cellules souches. Cette équipe suggère que ces organoïdes sont moins vulnérables que les neurones individuels en ce qui concerne la procédure de greffe et pourraient constituer de meilleurs produits de thérapie cellulaire.
- Greffer des organoïdes chez le modèle murin
Pour ce projet, les chercheurs proposent de greffer des organoïdes neuraux contenant les types de neurones spécifiques pour chaque maladie (des neurones dopaminergiques pour la maladie de Parkinson et des neurones GABAergiques pour la maladie de Huntington) chez des modèles murins de la maladie de Parkinson ou de la maladie de Huntington. Ainsi, les chercheurs pourront étudier le potentiel thérapeutique de ces greffons chez le modèle animal avec le projet de pouvoir ensuite proposer une thérapie cellulaire pour les patients.
La validation de cette approche jusqu’à un stade pré-clinique nécessite l’implication de différents partenaires ayant chacun une expertise spécifique. Le projet Parkington a l’ambition d’apporter une amélioration majeure à la thérapie cellulaire permettant une véritable alternative aux traitements symptomatologiques médicamenteux des maladies neurodégénératives.
Les avancées du projet
L’équipe est parvenue à développer une technologie d’encapsulation de cellules souches permettant de produire un très grand nombre de cellules, de les différencier dans le type cellulaire désiré et ceci dans des conditions de qualité et sécurité optimales. Le projet Parkington visait à tester, dans des modèles rongeurs des maladies de Parkinson et Huntington, la capacité de telles capsules de neurones à corriger les désordres moteurs provoqués par le modèle. Les chercheurs ont démontré, en tout cas dans la maladie de Parkinson, leur capacité à corriger les altérations motrices deux fois plus vite qu’avec des greffes classiques et ce indépendamment de la source de cellules souches (trois sources différentes ont été testées), indiquant par-là que la technologie est mature et prête pour un développement préclinique. L’équipe se dirige donc vers l’étape suivante qui sera la preuve de concept chez le primate non-humain, étape fondamentale dans la validation préclinique de la stratégie. En parallèle, les cellules souches seront qualifiées pour la production de lots cliniques avec une étude clinique à l’horizon 2024-2025.
L’innovation de ce projet réside ainsi dans l’encapsulation à haut débit des cellules souches pour permettre leur expansion (croissance et multiplication) puis leur différenciation (production d’un type cellulaire spécifique – ici les neurones dopaminergiques pour la maladie de Parkinson). Cette étape non seulement confère une capacité productive inégalée mais offre aussi la possibilité de greffer des neurones matures, à l’opposé des stratégies habituelles utilisant des cellules progénitrices (et donc non encore différenciées en un sous-type neuronal).
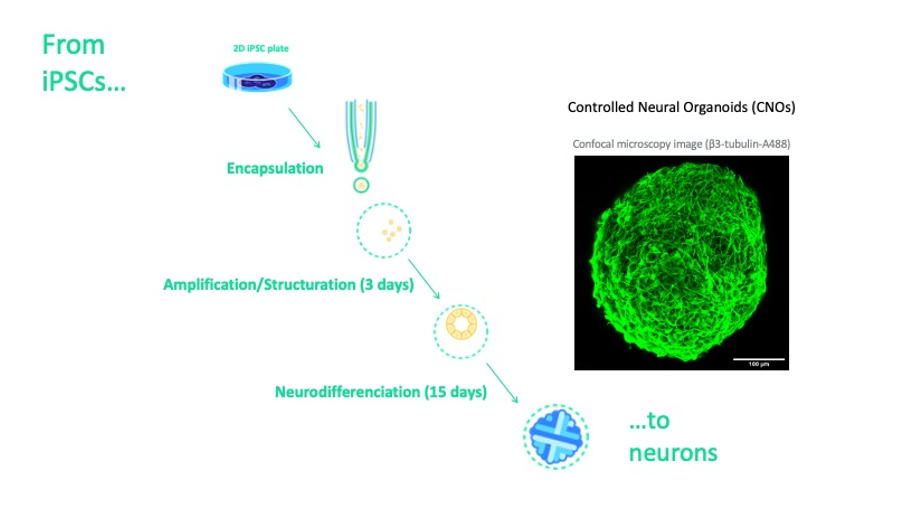
Processus de croissance et différentiation de cellules souches en neurones matures par la technologie d’encapsulation à haut débit.
Les publications et communications
Les résultats n’ont pas encore été publiés mais on fait l’objet de communications au cours du meeting NECTAR (Edinburgh, 8-10 Novembre), la conférence mondiale de référence pour les greffes neuronales.
Photo : © Inserm
Pour recevoir les actualités de la recherche, inscrivez-vous à notre newsletter :
Les cellules souches pluripotentes
Ces cellules ont les propriétés de pouvoir se renouveler indéfiniment et de devenir tous types de cellules. Au cours de la dernière décennie, les cellules souches pluripotentes ont permis d’avoir accès à toutes sortes de cellules humaines, dont les neurones pour lesquels l’intérêt est majeur étant donné la difficulté d’accéder et d’obtenir des neurones humains. De plus, cette technique permet de développer in vitro des neurones correspondant spécifiquement à un individu.

Portrait du chercheur
Erwan Bezard, DR1 INSERM est l’auteur ou le coauteur de plus de 250 publications dans le domaine de la neurobiologie, dont la plupart sont sur la maladie de Parkinson et les troubles connexes.

Le centre de recherche
Ce projet est issu d’une équipe de l’Institut des Maladies Neurodégénératives (IMN) de Bordeaux.
« Le financement FRC a permis de collecter les données nous ayant ensuite permis d’obtenir une ANR. L’effet de levier a été massif en montrant que le projet était digne d’intérêt. La combinaison de financements (FRC et ANR) a permis de mener à bien les études rongeurs indispensables à la preuve scientifique de la supériorité de la greffe de neurones matures (par rapport à des progéniteurs). Ce programme est maintenant développé par une société industrielle qui ambitionne d’amener la technologie en phase clinique. Le financement FRC peut donc se prévaloir d’un effet de levier majeur pour cette technologie. »

Soutenez les chercheurs !
Pour que la recherche sur les dysfonctionnements du cerveau progresse, vos dons sont indispensables.

"Plasticité et réparation : réparer le cerveau et/ou la moelle épinière"
> Voir tous les projets financés par a FRC en 2018 sur ce thème